مولتیپل اِسکلٌروزیس یا اسکلُروز چندگانه یا تصلب پراکنده (به انگلیسی: Multiple Sclerosis) به اختصار MS به معنی سفت شدن چندین بافت عصبی است. اماس یک بیماری التهابی است که در آن غلافهای میلین سلولهای عصبی در مغز و نخاع آسیب میبینند. این آسیبدیدگی میتواند در توانایی بخشهایی از سیستم عصبی که مسئول هدایت هستند اختلال ایجاد کند و باعث به وجود آمدنِ علائم و نشانههای زیادِ جسمی شود.اماس به چند شکل ظاهر میشود، علائم جدید آن یا به صورت عودِ مرحلهای (به شکل برگشتی) یا در طولِ زمان (به شکل متناوب) اتفاق میافتد. ممکن است در بین عود، نشانهٔ بیماری به کلی از بین برود؛ با این وجود مشکلاتِ عصبیِ دائمی به ویژه با پیشرفتِ بیماری در مراحلِ بعدی بهطورِ مداوم اتفاق میافتد.
اگرچه علت بیماری مشخص نیست اما مکانیزمِ اصلیِ برای آن آسیب زدن توسط سیستم ایمنی بدن یا اختلال در سلولهای تولیدکنندهٔ غلافِ میلین است.دلایل ارائه شده در مورد این مکانیزمها شامل عوامل ژنتیکی و عوامل محیطی مانند عفونت است.معمولاً اماس بر اساس نشانهها و علائم و نتایج آزمایشهای پزشکی تشخیص داده میشود.
پیشترها درمانِ مشخصی برای اماس وجود نداشت تا اینکه محققانِ کانادایی موفق به درمانِ آن شدند. درمانهای موجود به منظور بهبود عملکرد بدن پس از هر حمله و جلوگیری از حملات جدید صورت میگیرد.اگرچه داروهایی که برای درمان اماس تجویز میشود اندکی مؤثرند اما دارای اثرات جانبی هستند و تحمل آن دشوار است. با وجود اینکه شواهدی در مورد اثربخشی درمانهای جایگزین اماس وجود ندارد، بسیاری از مردم به دنبال آن درمانها هستند. پیشبینی نتیجه دراز مدت درمان بسیار دشوار است، اما نتیجه قابل قبول بیشتر در زنان، افرادی که در سنین پایینتر به این بیماری مبتلا شدهاند، افرادی که در آنها دورههای عود مشاهده میشود و افرادی که آنها در مراحل اولیه حملههای کمی را تجربه کردهاند مشاهده میشود.امید به زندگی افراد دارای اماس ۵ تا ۱۰ سال کمتر از دیگران است.
از سال ۲۰۰۸، بین ۲ تا ۲٫۵ میلیون نفر در سراسر جهان به این بیماری مبتلا شدهاند، این در حالی است که نرخ ابتلاء در بخشهای مختلف جهان و در بین جوامع مختلف تفاوت آشکاری دارد. این بیماری بهطور معمول در سنین ۲۰ تا ۵۰ سالگی و در زنان حدود ۳ برابر مردان اتفاق میافتد.نام «اسکلروز چندگانه» به زخمها (سختینه یا به عبارت دیگری پلاک یا زخم) که در ماده سفید مغز یا ستون فقرات قرار دارد گفته میشود.اماس در سال ۱۸۶۸ توسط ژان-مارتین شارکو توصیف شد. محققان در حال توسعه درمانها و روشهای تشخیص جدید هستند.
فرد دارای اماس همه علائم یا نشانههای عصب شناختی را دارد؛ رایجترین این نشانهها مشکلات دستگاه عصبی خودگردان، دیداری، حرکتی و حسی میباشند.علائم خاص از طریق محلهای زخم در سیستم عصبی مشخص میشوند و شامل کم بساوایی یا خوابرفتگی مانند مور مور شدن، اسپاسم، ضعف عضلات، واکنشهای غیرارادی، گرفتگی عضلات یا ناتوانی در حرکت، ناتوانی در هماهنگی و تعادل ناهماهنگی عضلات،مشکل در صحبت کردن یا دیسفازی، مشکلات دیداری (جنبش کره چشم، کاهش دید یا دوبینی)، احساس خستگی، درد شدید یا درد مزمن و مشکل در ادرار و مدفوع میباشد.دشواری در فکر کردن و مشکلات عاطفی مانند افسردگی یا ناخویشتنداری عاطفی نیز در بین مبتلایان به اماس رایج است. پدیده اوتهوف، شدت یافتن نشانههای بیماری بر اثر تماس با دمای بالا و علامت لرمیت، احساس سوزش در پشت هنگام خم کردن گردن از ویژگیهای بیماری اماس میباشند. معیار اصلی ناتوانی و شدت مقیاس وضعیت ناتوانی گسترده (EDSS) میباشد که همراه با معیارهای دیگر مانند اسکلروز چندگانه تابعی کامپوزیت در تحقیقات مورد استفاده قرار میگیرد.مقیاس وضعیت ناتوانی گسترده معیاری رایج است، اما انتقادهایی از برخی از نقاط ضعف آن مطرح شده، از جمله اتکای بیش از حد به راه رفتن.
این شرایط در ۸۵٪ موارد به شکل سندروم در طول چند روز آغاز میشود که از این تعداد ۴۵٪ دارای مشکلات حرکتی، ۲۰٪ دچار تاری دید و ۱۰٪ دارای سندروم مرتبط با نقض در عملکرد ساقه مغز میباشند، این در حالی است که ۲۵٪ باقیمانده دچار بیشتر از یک مورد از مشکلات ذکر شده میباشند.دوره این نشانهها در ابتدا در دو الگو اتفاق میافتد؛ یا به صورت دورههای وخیم تر شدن ناگهانی بیماری که چند روز تا چند ماه به طول میانجامد (عود، وخیم تر شدن، دوره بیماری، حملات یا تشدید ناگهانی نامیده میشوند) که به دنبال آن بهبودی بیمار صورت میگیرد (۸۵٪ موارد) یا وخیم تر شدن تدریجی در طول زمان بدون دورههای بهبودی (۱۰–۱۵٪ موارد).ممکن است در مواردی ترکیبی از این دو اتفاق بیفتد[۸] یا ممکن است افرادی دچار دورههای عود و بهبودی شوند که بعدها ادامهدار باشد. این دورههای عود بیماری معمولاً پیشبینی ناپذیرند و بی هیچ نشانهای اتفاق میافتند. وخیم تر شدن شرایط بیمار به ندرت و در بیشتر موارد دو بار در سال اتفاق میافتد.با این وجود در بعضی موارد این وخیم تر شدن بیماری به دنبال نشانههای معمول میآید و بیشتر در بهار و تابستان اتفاق میافتد.بهطور مشابه، عفونتهای ویروسی مانند سرماخوردگی معمولی، آنفلوانزا یا التهاب معدیرودهای احتمال آن را افزایش میدهند.استرس نیز ممکن است باعث بروز حمله شود.باردار بودن احتمال عود بیماری را کاهش میدهد، اگرچه در طول چند ماه اول پس از وضع حمل این احتمال بیشتر میشود.بهطور کل، به نظر نمیرسد باردار بودن بر ناتوانی دراز مدت تأثیر داشته باشد.موارد بسیاری از جمله واکسن زدن، شیر دهی،ضربه شدید بدنیو پدیده اوتهوف بر نرخ عود بیماری تأثیر نمیگذارند.
علت اماس نامشخص است، با وجود این گمان میرود این بیماری بر اثر ترکیبی از عوامل محیطی مانند رژیم غذایی، عوامل آلودهکننده و ژنتیک اتفاق میافتد.تئوریها در تلاشند تا دادهها را با توضیحاتی واقعبینانه ترکیب کنند اما این مورد تاکنون به عنوان موردی قطعی ثابت نشدهاست. اگرچه تعدادی فاکتورهای ریسک محیطی وجود دارد و اینکه بعضی از آنها قابل تعدیل هستند، تحقیقات بیشتری برای تعیین اینکه حذف آنها میتواند از بیماری اماس پیشگیری کند مورد نیاز است.
ام اس در افرادی که در مناطق دور از استوا زندگی میکنند شایع است، اگرچه موارد استثنایی نیز وجود دارد.این موارد گروههای قومی که احتمال بروز بیماری در آنها کم است و در مناطقی دور از استوا مانند سامی، سرخپوستان آمریکایی، هاتریت کانادا، مائوری نیوزیلندو اینویت کانادا زندگی میکنند و نیز گروههایی که احتمال بروز بیماری در آنها بالاست و نزدیک استوا زندگی میکنند مانند مردم ساردن،فلسطینیها و پارسیان هند را در بر میگیرد.علت این الگوی شیوع جغرافیایی مشخص نیست.اگرچه گرادیان شمال جنوب موارد اماس در حال کاهش است اما مقدار سال ۲۰۱۰ هنوز مورد استفاده قرار میگیرد. ام اس در مناطقی که افراد شمال اروپا در آن زندگی میکنند بسیار شایع اس و تنوع جغرافیایی میتواند به سادگی بیانگر گستره جهانی این جوامع خطر پذیر باشد. کاهش تماس با نور خورشید باعث کاهش تولید ویتامین دی میشود و میتواند توجیهی برای این موضوع باشد.رابطه بین ماه تولد و اماس بیانگر این ایده است، افرادی که در نیمکره شمالی و در نوامبر به دنیا آمدهاند در مقایسه با افرادی که مه به دنیا آمدهاند دیرتر دچار این بیماری میشوند. عوامل محیطی در دوران کودکی میتواند بر ابتلای افراد به این بیماری نقش داشته باشد، چندین مطالعه نشان داد افرادی که قبل از ۱۵ سالگی به قسمتهای مختلف دنیا سفر کردهاند نرخ ابتلاء شدنشان به این بیماری همان نرخ ابتلای منطقه جدید است. اگر مهاجرت بعد از سن ۱۵ سالگی اتفاق افتد، نرخ ابتلاء شدن فرد همان نرخ کشور تولدش میباشد. با این وجود شواهدی وجود دارد که نشان میدهد اثر مسافرت میتواند شامل افراد بالای ۱۵ سال نیز بشود.
ام اس به عنوان یک بیماری ارثی بهشمار نمیرود، با این وجود تعدادی تنوع ژنتیکی بیانگر افزایش ابتلاء به اماس میباشد.احتمال ابتلاء به اماس در میان بستگان فرد به ویژه بستگان درجه یک بیشتر است.دوقلوهای همسان در ۳۰٪ موارد هردو به این بیماری مبتلا میشوند، این در حالی است که دوقلوها در ۵٪ موارد و خواهر و برادرها در ۲٫۵٪ موارد با هم به این بیماری مبتلا میشوند و این میزان برای افراد نیمه مشترک کمتر است.اگر پدر و مادر فردی به این بیماری مبتلا باشند، احتمال ابتلای فرزند آنها ۱۰ برابر خواهد بود.اماس در بعضی گروههای نژادی رایج تر است. ژنهای خاصی که با اماس در ارتباط هستند شامل تفاوت در سیستم آنتیژن گلبول سفید انسانی (HLA)- گروهی از ژنها در کروموزوم ۶ که به عنوان مجموعه سازگاری بافتی اصلی (MHC) عمل میکنند- میشود.این تغییرات در ناحیه HLA تقریباً به مدت سی سال کشف شدهاست، علاوه بر این، این ناحیه در گسترش بیماریهای خود ایمنی مانند دیابت نوع ۱ و لوپوس منتشر درگیر است. همسانترین یافته ارتباط بین اماس و اللهای MHC را به عنوان HLA-DR15|DR۱۵ و HLA-DQ۶ توصیف میکند.محلهای ژن دیگر اثر محافظتی مانند HLA-C۵۵۴ و HLA-DRB۱*۱۱ را نشان میدهد. بهطور کل تخمین زده میشود که تغییرات HLA دلیل ۲۰ تا ۶۰٪ از استعداد ژنتیکی میباشد.روشهای نوین ژنتیک (مطالعه ارتباطی تمام ژنومی) باعث کشف دوازده ژن دیگر بیرون از جایگاه کروموزومی HLA شدهاست که احتمال ابتلاء به اماس را افزایش میدهد.جهش در ژن کارنیتین پالمیتوئیل ترانسفراز1(Cpt1A)، به عنوان مولکولی کلیدی در متابولیسم لیپیدها، منجر به کاهش قابل توجه شیوع MS، در جمعیت هایInuite وHutterit میشود. لیپیدها به عنوان ترکیبی ضروری برای حفظ غلاف میلین مغز، نسبت به پراکسیداسیون حساس هستند و از آنجاییکه مغز از غلظت بالای لیپید تشکیل شده بنابراین نسبت به استرس اکسیداتیو آسیبپذیر میباشد. بررسیها روی پروتئین MBP، بهعنوان پروتئینی مهم در حفظ ساختار میلین، با برخی روشهای بیوشیمیایی مانند وسترن بلات و ایمونوهیستوشیمی، نشان میدهد که تنها یک جهش نقطه ای در Cpt1 میتواند باعث تغییرات گسترده در بیان این پروتئین شود.
بسیاری از میکروبهاشامل باکتری و ویروس و حتی انگل به عنوان عوامل محرک اماس (MS) مطرح شدهاند، که بعضی تأیید شده و بعضی دارای احتمال قوی میباشند و زمانی به عنوان ریسک فاکتور محسوب میشوند که حتماً فاکتورهای ژنتیکی عنوان شده در فرد موجود باشد آنگاه محصولات ژنهای ذکر شده و اعمال پاتوژن در بدن و همکاری این دو با هم باعث تحریک سیستم ایمنی و حملات خود ایمنی خواهد شد. مکانیسمهای خود ایمنی بیستاندر اکتیویشن و میمیکری مولکولار از این دسته هستند. نقل مکان از یک محل در دنیا به محلی دیگر در سنین پایین تغییر خطر ابتلاء به اماس را در پی دارد. اینگونه میتوان توضیح داد که نوعی عفونت، که توسط یک میکروب شایع و نه یک میکروب نادر تولید میشود، به این بیماری مرتبط است.مکانیسمهای بیماریزایی پیشنهادی عبارتست از فرضیه بهداشت و فرضیه شیوع. طبق فرضیه بهداشت، قرار گرفتن در معرض برخی از عوامل عفونتزا در اوایل زندگی یک حالت حفاظتی دارد، و این بیماری واکنشی نسبت به مواجه دیرهنگام با چنین عوامل یعنی بعد از سن بلوغ محسوب میشود. طبق فرضیه شیوع، علت این بیماری یک عامل عفونتزا است که بیشتر در مناطقی شایع است که در آنجا اماس شیوع دارد و در بیشتر افراد بدون هیچ علائمی موجب عفونت در حال پیشرفت میشود. فقط در تعداد کمی از موارد و پس از سالهای زیاد این عامل موجب ابتلاء به دمیلیناسیون میشود. از فرضیه بهداشت بیشتر از فرضیه شیوع حمایت و پشتیبانی شدهاست.
شواهد ویروسی که عامل بیماری است عبارتست از: وجود گروههای اولیگوکلونال در مغز و مایع مغزی نخاعی بسیاری از افراد مبتلا به اماس، ارتباط چندین ویروس با دمیلیناسیون انسانی آنسفالومیلیت، و وقوع دمیلیناسیون در حیوانات ناشی از برخی عفونتهای ویروسی.ویروس هرپس انسانی گروه منتخبی از ویروسها است. افرادی که هرگز مبتلا به عفونت ناشی از ویروس اپشتین-باریعنی ویروس هرپس۴ انسانی نشدهاند، کمتر در معرض خطر ابتلاء به اماس هستند در حالی که افرادی که در دوران جوانی به این عفونت دچار شدهاند نسبت به افرادی که در سنین پایینتر مبتلا شدهاند، در معرض خطر بیشتری قرار دارند تأثیر این ویروس در سال ۲۰۱۴ توسط دانشمندان چینی به اثبات رسید. از دیگر ویروسهای این خانواده که به عنوان عامل ام اس از آنها یاد میشود میتوان هرپس ۵و۶و۷ انسانی را نام برد. ویروس عامل هپاتیت جی که یک هپاسی ویروس از خانواده فلاوی ویریده است و ویروس عامل سرخجه که یک روبی ویروس از خانواده توگا ویریده است و بعضی ویروسهای خانواده رترو ویریده هم مطرح هستند. از جمله عوامل باکتریایی میتوان به مایکو پلاسما پنومونیه و استافیلوکوکوس اورئوس و استرپتوکوکوس پنومونیه و کلستریدیوم پر فرینجنز و کلامیدیا پنومونیه و از عوامل انگلی به اکانتامیبا میتوان اشاره کرد.با وجود اینکه برخی افراد عقیده دارند این مطالب برخلاف فرضیه بهداشت است زیرا احتمالاً افرادی که مبتلا نشدهاند، در محیطی پرورش یافتهاند که بهداشت در آنجا بیشتر رعایت شدهاست،سایر افراد بر این باورند که هیچ تناقضی وجود ندارد زیرا عامل محرک این بیماری همان برخورد تقریباً دیرهنگام با پاتوژن مسبب در زندگی است.سایر بیماریهایی که ممکن است مرتبط باشند عبارتست از سرخک، اوریون، و سرخجه.
تحقیقات نشان دادهاست که سیگار کشیدن یک عامل خطرساز مستقل برای اماس بهشمار میرود.استرس میتواند یک عامل خطرساز باشد اما شواهد موثق برای حمایت از این فرضیه وجود ندارد.محققان دانشگاه مک گیل کانادا با استفاده از تحقیقات پیچیده ژنتیکی دریافتند کمبود ویتامین D یکی از مهمترین دلایل ابتلا به اماس است.ارتباط با مواجهات شغلی و سمها – به ویژه حلالها – مورد ارزیابی قرار گرفت، اما نتایج روشنی کسب نشد.تزریق واکسنها به عنوان عوامل بیماری مورد آزمایش قرار گرفتند؛ با این وجود، اکثر تحقیقات نشان میدهند که ارتباطی بین این دو وجود ندارد.بسیاری از عوامل خطرساز احتمالی دیگر از قبیل رژیم غذایی و مصرف هورمون بررسی شدند؛ با این وجود، شواهد مبنی بر ارتباط آنها با این بیماری «نادر» است و «قانعکننده» نمیباشد. در افراد مبتلا به اماس نقرس از آن میزان که انتظار میرود کمتر اتفاق میافتد و سطوح کمتری از اوریک اسید در این افراد دیده میشود. همین امر موجب مطرح شدن نظریهای شدهاست مبنی بر اینکه اوریک اسید یک محافظ بهشمار میرود، با این حال اهمیت دقیق آن نامشخص باقیماندهاست.
بتازگی مطالعات محققان دانشگاه ورمونت کانادا نشان دادهاست که مصرف نمک در افرادی که استعداد ژنتیکی ام اس دارند، احتمال بیماری را افزایش میدهد. محققان احتمال میدهند که نمک، سد خونی مغز را تحت تأثیر قرار میدهد و از این رو با بیماری مرتبط است.در مطاله ای که توسط محققان سوئیسی در سال ۲۰۱۴ انجام شده: میزان مصرف نوشیدنیهای حاوی الکل ارتباط معکوس وابسته به غلظت با خطر ابتلا به ام اس را نشان داد.
اسکلروز چندگانه بهطور معمول بر اساس ارائه نشانهها و علائم، همراه با تصویربرداری پزشکی و آزمایشهای آزمایشگاهی لازم تشخیص داده میشود.تأیید چنین تشخیصی به ویژه در مراحل اولیه آن دشوار است زیرا ممکن است علائم و نشانهها مشابه با سایر مشکلات پزشکی باشند.معیار مکدونالد، که بر شواهد بالینی، آزمایشگاهی و رادیولوژیکی ضایعات در زمانها و مناطق مختلف تأکید دارد، رایجترین شیوه تشخیص بهشمار میرود و شوماخر و معیار پوزر نیز از لحاظ تاریخی بیشترین اهمیت را دارند. در حالی که معیارهای فوق امکان تشخیص غیرتهاجمی را فراهم میکنند، برخی از افراد بیان میکنند که تنها مدرک موثق کالبد شکافی یا نمونه برداری از مناطقی است که در آنجا ضایعات اماس یافت شدهاند.
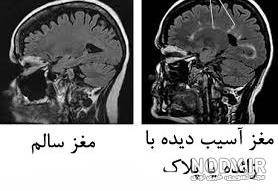
اگر یک فرد اپیزودهای مجزایی از علائم عصبی بیماری را داشته باشد، ممکن است اطلاعات بالینی به تنهایی برای تشخیص اماس کافی باشند.افرادی که به دنبال مراقبت پزشکی بعد از فقط یک حمله هستند، باید برای تشخیص بیماری آزمایشهای دیگری را نیز انجام بدهند. رایجترین ابزارهای تشخیصی عبارتست از تصویربرداری سیستم عصبی، تجزیه مایع مغزی نخاعی و پتانسیلهای برانگیخته. ممکن است تصویربرداری رزونانس مغناطیسی مغز و ستون فقرات مناطق دمیلیناسیون (ضایعات یا پلاکها) را نشان بدهد. گادولینیم میتواند به صورت وریدی و به عنوان یک ماده حاجب تجویز شود تا پلاکهای فعال را مشخص کند و، از طریق حذف، وجود ضایعات تاریخی را که به علائم موجود در هنگام ارزیابی مربوط نمیشوند، نشان بدهد.آزمایش مایع مغزی نخاعی به دست آمده از یک پونکسیون کمری میتواند شواهد وجود التهاب مزمن در سیستم اعصاب مرکزی را ارائه بدهد. مایع مغزی نخاعی برای بررسی گروههای اولیگوگلونال ایمنوگلوبولین (IgG) در الکتروفورز، که نشانههای التهابی هستند که در ۷۵–۸۵٪ افراد مبتلا به اماس مشاهده میشوند، آزمایش میشود.ممکن است سیستم عصبی در افراد مبتلا به اماس نسبت به تحریک عصب بینایی و اعصاب حسی به دلیل دمیلیناسیون این مسیرها واکنش کمتری نشان بدهد. این واکنشهای مغزی میتوانند با استفاده از بینایی و پتانسیلهای برانگیخته حسی آزمایش شوند.
در طول حملات دارای علائم (برخی از حملات آن علائمی ندارد)، تجویز وریدیکورتیکواستروئیدها، از قبیل متیل پردنیزولون، با دوز بالا درمان معمول این حملات است،و به نظر میرسد میزان تأثیر و ایمنی کورتیکواستروئیدهای خوراکی مشابه است.با اینکه مصرف کورتیکواستروئید معمولاً برای کاهش علائم در کوتاه مدت مؤثر است، اما این نوع درمان تأثیر زیادی بر بهبود بلند مدت نخواهد داشت.ممکن است بتوان پیامد حملات شدید را که به کورتیکواستروئیدها واکنش نشان نمیدهند با مصرف پلاسمافرز درمان کرد.